Metalele de tranziție (elemente)
Metalele de tranziție (elemente) sunt aranjate în subgrupuri laterale ale Sistemului Periodic D.
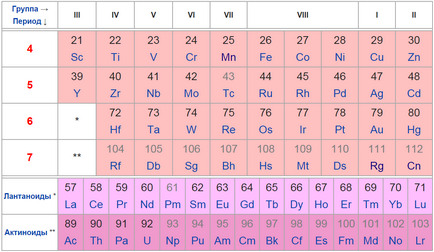
Metalele de tranziție (elemente) sunt aranjate in subgrupuri laterale DI a sistemului periodic Mendeleev. Acestea sunt împărțite în elemente și f elemente d-. -elemente f - este lantanide și actinide.
În general, structura electronică a elementelor de tranziție pot fi reprezentate după cum urmează: (n - 1) d x ns y. In ns-orbitali conține unul sau doi electroni, electronii de valență rămase sunt pe (n - 1) d-orbitali. Deoarece numărul de electroni de valență semnificativ mai mic decât numărul de orbitali, substanțele simple, formate din elemente de tranziție, sunt metale.
Denumirea „tranzitorie“, datorită faptului că perioadele de elemente de tranziție sunt prinse între elementele și p S-.
Spre deosebire de elementele-p și care sunt S- umplute cochilii exterioare (respectiv ns- și np-shell), metale de tranziție umplute interior (n - 1) d-shell (d-elemente) sau (n - 2) f coajă (elemente-f).
Toate elementele de tranziție au următoarele caracteristici comune:
- Valorile mici de electronegativitate.
- Variind grade de oxidare. Aproape toate d-elemente, atomi din care la exterior subnivel ns-2 electroni de valență sunt cunoscute starea de oxidare +2.
- Deoarece elementele d-III ale tabelului periodic al elementelor Mendeleev Elementele din un inferior formează compuși stare de oxidare care prezintă proprietăți de bază în mai mare - acid. în intermediar - amfoterice. De exemplu:
- Pentru toate elementele de tranziție caracterizate prin formarea de compuși complecși.
metale Tabelul de tranziție.
In formarea compușilor de atomi metalici pot fi utilizate nu numai valență și p s--electroni, dar, de asemenea, d-electroni. Prin urmare, pentru d-elementele sunt mult mai caracteristice elemente de valență variabilă decât principalele subgrupe. Datorită acestei tranziții proprietate metale formează adesea compuși complecși.
Toate elementele de metal de tranziție. De aceea, în compușii lor, ele prezintă o stare de oxidare pozitivă. Cele mai multe dintre ele are un luciu metalic caracteristic. Comparativ cu s-metale puterea lor ca un întreg este mult mai mare. În special, ele sunt caracterizate prin proprietăți: rezistență ridicată la tracțiune; ductilitate; ductilitate (acestea pot aplatiza lovituri în foi).
Există trei membru notabil al familiei metalelor de tranziție. Aceste elemente - fier. cobalt și nichel. iar acestea sunt singurele elemente care sunt capabile de a crea un câmp magnetic.
Elemente de tranziție, altele decât Fe și Ti. nu larg răspândită în scoarța terestră.