Tipuri de reacții chimice, viața de student

Pentru a schimba compoziția următoarelor tipuri de reacții chimice:
- o modificare a compoziției (majoritatea);
- fără a schimba compoziția (izomerizare și conversia unei modificări alotropice la altul).
În cazul în care substanța nu se schimbă ca rezultat al reacției, este necesar să se schimbe structura sa, o astfel Cgrafit↔Calmaz
Să luăm în considerare clasificarea reacțiilor chimice care au loc cu o modificare a compoziției.
I. După numărul și compoziția substanțelor
Ca rezultat al proceselor chimice ale mai multor substanțe produse una: A + B + C = ...
- Substanțe simplu: 2Na + S = Na2S;
- simplu la complex: 2SO2 + O2 = 2SO3;
- doi esteri: CaO + H2O = Ca (OH) 2.
- mai mult de două substanțe: 4Fe + 3O2 + 6H2O = 4Fe (OH) 3
O singură substanță în astfel de reacții pot fi extinse la alte câteva: A = B + C + ...
Produsele, în acest caz, poate fi:
- Substanțe simplu: 2NaCI = 2Na + Cl2
- simplu și complex: 2KNO3 = 2KNO2 + O2
- doi esteri: CaCO3 = CaO + CO2
- mai mult de două produse: 2AgNO3 = 2AG + O2 + 2NO2
Astfel de reacții care reacționează între o simplă și o substanță complexă, simpli atomi de substanță substituită cu atomi de unul dintre elementele din complex, și se numește reacții de substituție. Schematic, procesul de înlocuire a atomilor pot fi afișate ca: A + B + BC = AC.
De exemplu, CuSO4 + Fe = FeSO4 + Cu
In acest grup includ reacția în care substanța doi esteri schimbă părțile sale: AB + CD = AD + CB. Conform regulii Berthollet, desigur ireversibilă a acestor reacții este posibilă în cazul în cazul în care cel puțin unul dintre produsele:
- precipitarea (substanță insolubilă): 2NaOH + CuSO4 = Cu (OH) 2 + Na2SO4;
- agent malodissotsiiruyuschee: NaOH + HCl = NaCl + H2O;
- gaz: NaOH + NH4Cl = NaCl + NH3 + H2O (format inițial hidrat amoniac NH3 • H2O, care la primirea imediat la amoniac se descompune și apă).
II. Prin efect termic
- Exoterme - procese care au loc cu degajare de căldură:
C + O2 = CO2 + Q - Endotermic - reacții în care căldura este absorbită de:
Cu (OH) 2 = CuO + H2O - Q
III. Tipuri de reacții chimice în direcția
- reacții reversibile Chemat care apar în același timp, atât înainte și direcția inversă: N2 + O2 ↔ 2NO
- procesele ireversibili avea loc înainte de sfârșitul anului, adică atâta timp cât cel puțin unul dintre reactanți sunt folosite complet. Exemple de reacții de schimb ireversibile au fost discutate mai sus.
IV. Prin prezența catalizatorului
- Reacțiile catalitice cum sugerează și numele lor, apar în prezența catalizatorilor:
- Reacția non-catalitice, catalizatorul nu este utilizat.
V. La starea fizică a materiei
- Dacă toți reactanții sunt în aceeași stare de agregare, reacția se numește omogenă. Astfel de procese au loc în întregul volum. De exemplu: NaOH + HCl = NaCl + H2O
- Numitele reacții eterogene între substanțele aflate în diferite stări de agregare care apar la interfața. De exemplu: Zn + 2HCl = ZnCl2 + H2 ↑
VI. Tipurile de reacții chimice pentru a modifica gradul de reactanți oxidare
- Redox (OVR) - reacții care modifică starea de oxidare a reactanților.
- Reacțiile fără grade schimbare de reactanți de oxidare (GIACS).
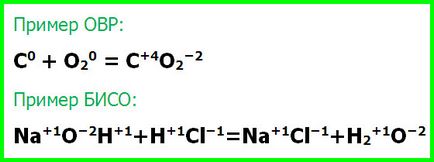
Întotdeauna procesele redox sunt de ardere și de înlocuire. Reacțiile de schimb apar fără o schimbare de oxidare a substanțelor de grade. Toate celelalte procese pot fi atât ISI și GIACS.