Stabilitatea compușilor complecși
În soluții de compuși complecși ai unui sistem de echilibru dinamic, adică. Compușii E. complexe sunt supuse unui grad mare de disociere electrolitica. Ionii sau molecule prezente în sfera externă, legate în complex este mult mai slabă decât ionii sau moleculele din sfera interioară. Astfel de tipuri de forță de legătură cauzează disocierea naturii complexe a compușilor.
Disocierea complexe are loc în etape. În prima etapă, compus complex este disociat ca un puternic electrolit, t. E. Aproape complet. În plus, ionul complex ca un electrolit slab disociază în etape, adică. E. Separate de complexarea liganzi gradat. De exemplu, disocierea sării complexe [Ag (NH3) 2] CI procedează în conformitate cu următoarele etape:
Disocierea complexului este doar într-o mică măsură și pot fi caracterizate prin amploarea totală a constantelor de ionizare a complexului, care este definit ca produsul dintre constantele de disociere pentru etapele individuale. Astfel, în acest exemplu
Cea mai mare valoare a acestei constante, disociaza mai complexe, cu atât mai puțin stabil. Această constantă se numește instabilitatea constantă. Reciproca constantelor de instabilitate numit constantă stabilitate:
constantă instabilitate pentru diverși ioni complecși sunt diferite și pot fi o măsură a stabilității complexului. Cele mai stabile în soluții de ioni complecși au cele mai mici constante de instabilitate. De exemplu, printre compușii
compuși complecși
Educația k / s, datorită capacității cationilor Me atașate molecule specifice și / sau ioni încărcați negativ.
Cu2 ++ 4NH3 = [Cu (NH3) 4] 2+
NH3 + H + → NH4 +
[] - conexiunea este puternică - donornoaktsektornaya-ne
Ca parte a ionului complex poate distinge ion-complexare Cu2 +, molecula legate de amoniac (liganzi de liganzi - legat de ioni / molecula sau de otritsatelnozaryazhennye ioni) NH3.
Anionii - ioni Neg / încărcare: OH-, CI-, Br-, J-, CNS-, CN-
4 - coordonate număr [Cu (NH3) m], adică k / h indică numărul de liganzi atașați la ion-k / o.
Ion-k / o și sfera interioară liganzilor formează la / de la [...]. Counterionii înconjurătoare Ion complexe constituie sfera exterioară. Taxa ionului complex este suma algebră a taxelor de ion-k / O și liganzi. În cazul în care sunt liganzi anioni, sarcina ionului complex devine negativ.
[Cu (CN) 4] 2- CN- * 4 = -4 Cu = + 2 => -2
[Al (OH) 6] 3- - gidroksoalyuminat
Adesea, un / h este egală cu dublul gradului de ioni la / despre oxidare. K / s se poate aplica la diferite clase: săruri, baze, acizi.
În principiu, construcția denumirii la / s (nominklatury) reține dispozițiile care au fost adoptate pentru conexiuni normale, dar are propriile sale caracteristici. Numele C / S a înregistrat structura sa de la dreapta la stânga, în numele ionului complex (și anume că, în [...]) au fost transferate succesiv la un număr de liganzi, numele ligandului, numele unui cuvinte ion-k / o, și pentru anionul utilizat latin pe bază și pentru cation - Rusă.
[Cu (NH3) 4] 2+ tetraaminmedi ion (II);
NH3-amină; CN-tseano
Ag (NH3) 2] + - silver diamină ion
[Al (H2O) 6] 3+ - aluminiu geksaakva ion
[Al (OH) 4] - - tetragidroksoalyuminat
[Cu (CN) 4] 2- - tetratsianokuprat (II)
[Al (OH) 6] 3- geksagidroksoalyuminat
[Fe (CN) 6] 3- - geksatsianoferat III
[Fe (CN) 6] 4- geksatsianoferat II
[Cu (NH3) 4] SO4 - sulfat de cupru tetraminice
K2 [Zn (OH) 4] - tetragidroksotsinkat de potasiu
K3 [Fe (CN) 6] 3- geksatsianoferat (III) de potasiu
K4 [Fe (CN) 6] 3- geksatsianoferat (II) de potasiu
[Cu (NH3) 4] (OH) 2 - cupru gidroaksidtetraamin II
H2 [TiCl6] - Acid geksahlortitanovaya
K / h R / h
Al3 + 4,6 Ag + 2
4 Zn2 + Hg + 2
Fe2 + 4,6 Hg2 + 4
Fe3 + 4,6
O modalitate de a obține / s bazat pe introducerea chimice în sistem pentru a crea un exces de liganzi raport corespunzător numărului de coordonare. Pe baza acestei reacții de dizolvare principiu a unor precipitații, inclusiv hidroxizi amfoteri în soluții alcaline.
Zn (OH) 2 (peleți) + 2KOH = K2 [Zn (OH) 4]
Zn (OH) 2 + 2OH - = [Zn (OH) 4] 2-
AlCl3 + 3KOH = ↓ Al (OH) 3 + 3KCl
Al (OH) 3 + KOH = K [Al (OH) 4]
Al (OH) 3 + 3KOH = K3 [Al (OH) 6]
HgJ2 (oadok) + 2KJ = K2 [HgJ4] -2 - tetraiodogidroargat (II) de potasiu
HgJ2 + 2J - = [HgJ4] 2-
Compușii complecși au multe proprietăți comune ale compușilor (de exemplu: reacția de schimb care implică două săruri 3FeCl2 + 2K3 [Fe (CN) 6] = Fe3 [Fe (CN) 6] + 6KCL
3Fe2 ++ 2 [Fe (CN) 6] 3- = Fe3 [Fe (CN) 6])
Pentru k / s sunt caracteristice reacțiilor specifice asociate cu înlocuirea unui alt ligand.
[Cu (H2O) 4] SO4 + 4NH3 = [Cu (NH3) 4] SO4 + 4H2O
[Cu (H2O) 4] 2 ++ 4NH3 = [Cu (NH3) 4] + 4H2O
CN-> NO2-> NH3> CNS-> H2O> OH-> CI-> Br-> J- *
Abilitatea de a înlocui un alt ligand asociat cu puterea ionilor Komlov. K / n crește puliciat de ioni cu puterea de ligand (a se vedea mai sus gama *). Liganzii situate pe partea stângă a nazyv puternice pe partea dreapta - slab (față de centru).
Când este dizolvat în apă la / de tip divizat electroliți puternici ioni și ionii Complexe încărcate opus mediului.
K2Zn (CN) 4] → 2K ++ [Zn (CN) 4] 2-
[Cu (NH3) 4] SO4 → [Cu (NH3) 4] 2 ++ SO42-
În soluții apoase, acest proces este aproape în întregime (descompunere electrolit de ioni).
[Zn (CN) 4] 2- ← → Zn2 ++ 4CN- *
Pentru caracterizarea Compl tăria ion introdus conceptul: instabilitatea constantelor Kn, Kn care reprezintă disocierea com ion *
Kn = (CZn2 + C4CN -) / C [Zn (CN) 4], unde C - concentrația, Kn-conținute în manuale. Mai mici valoarea Kn, cu atât mai puternică Compel ionul activ.
Sarcina 12.
Bazat pe entalpiile standard de formare a # 916; H # 730; 298 și entropia absolută S # 730; 298 substanțe definesc: 1) # 916; H 730 #; 298 reacție # 916; S # 730; 298 și reacția # 916, G # 730; 298 răspunsuri. Concluzii despre probabilitatea termodinamică a reacției în condiții standard; 2) temperatura la care constantele de echilibru care, reacția este egal cu una (# 916, reacția G este bine lu). efectul temperaturii asupra # 916; H și # 916; S reacție neglijabilă; 3) regiunea de temperatură în care fluxul reacției termodinamic probabilă. Calculele de ecuații dețin-gropi reacțiile enumerate în tabel.
Rata reacțiilor chimice
A.A. Belyaev, VV Zagorski, E.A. Mendeleev, DI Mendeleev, V. Minaylov,
NI Morozova, A.E. mural
- Rata de reacție chimică. Definiția.
- Influența asupra concentrațiilor vitezei de reacție chimică.
- Efectul presiunii asupra vitezei reacției chimice.
- Efectul suprafeței de contact a reactanților în viteza de reacție chimică.
- Influenta naturii reactantilor chimice asupra vitezei de reacție.
- Efectul temperaturii asupra vitezei de reacție chimică.
- Cataliza și inhibare.
- Material suplimentar
- experimente
- sarcini
- test
Opțiuni 1-8. Se calculează numărul de ori crește viteza-chim reacții la temperaturi mai ridicate cal, în cazul administrării SG valoare.
regula Van't Hoff - regula de degetul mare, care permite o primă aproximare pentru a evalua efectul temperaturii asupra vitezei de reacție chimică într-un interval de temperatură mică (în general de la 0 ° C până la 100 ° C). JH Van't Hoff pe baza mai multor experimente formulate următoarele reguli:
Când temperatura crește la fiecare 10 grade viteza de reacție elementar omogen constant crește în două - patru ori.
Ecuația care descrie această regulă după cum urmează:
în care: - viteza de reacție la temperatura. - viteza de reacție la temperatura. - coeficientul de temperatură (dacă este 2, de exemplu, viteza de reacție va crește de 2 ori prin creșterea temperaturii cu 10 grade).
Trebuie amintit că regula van't Hoff se aplică numai pentru reacțiile cu o energie de activare de 60-120 kJ / mol, în intervalul de temperatură de 10-400 ° C. Regula van't Hoff, de asemenea, nu sunt supuse reacțiilor care implică molecule voluminoase, cum ar fi proteinele din biologice sisteme. Dependența de temperatură a vitezei de reacție descrie mai precis ecuația Arrhenius.
Din van't Hoff coeficientul de temperatură se calculează cu formula:
Viteza de reactie omogenă - este numărul de substanțe care urmează să fie reacționați sau formate prin reacția pe unitatea de timp pe unitatea de volum a sistemului:
Cu alte cuvinte, viteza de reacție omogenă egală cu modificarea concentrației molare a oricăruia dintre reactanți pe unitatea de timp. Viteza de reacție - o valoare pozitivă, așa că, dacă expresia prin schimbarea concentrației produsului de reacție a pus semnul „+“, în timp ce schimbarea concentrației mărcii reactiv „-“.
Scrieți o expresie constanta de echilibru a reacției reversibile prezentată în tabel. Determina ce sute Rhone-schimbare echilibrul reacțiilor reversibile: a) atunci când temperatura a crescut-shenii (p = const); b) atunci când presiunea (T = const).
reacție exotermă - o reacție chimică este însoțită de eliberarea de căldură. Opus Reacția endotermă. Cantitatea totală de energie într-un sistem chimic este extrem de dificil de măsurat sau conta. Pe de altă parte, schimbarea entalpie # 916; H reacțiile chimice sunt mult mai ușor de măsurat sau conta. Pentru aceste scopuri calorimetre. valoarea măsurată # 916; H este legată de energia de legare moleculară după cum urmează: # 916; obligațiuni H = energie uzat rupere (energie bond-disociere) - energia eliberată în timpul formării de legături ale produșilor de reacție. Această formulă dă o valoare negativă pentru reacțiile exoterme pentru # 916; H, deoarece valoarea mai mare se scade din valoarea mai mică. Când combustia hidrogenului, de exemplu: 2H2 + O2 → 2 H2O egală cu modificarea entalpiei # 916; H = -483.6 kJ per mol O2.
reacție endotermă (din greaca veche. # 7956; # 957; # 948; # 959; # 957; - și # 952; # 941; # 961; # 956; # 951; - căldură) - reacții chimice însoțite de absorbție a căldurii. Pentru reacțiile endoterme, schimbarea entalpie a energiei interne și au valori pozitive (). Astfel, produsele de reacție conțin mai multă energie decât componentele originale. Pentru reacțiile endoterme includ:- reacția de reducere a oxizilor de metal,
- electroliza (energie electrică absorbită)
- disociere electrolitica (de exemplu, dizolvarea sărurilor în apă)
- ionizare
- fotosinteza.
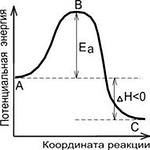
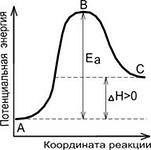
Efectul T pentru a schimba echilibrul chimic. T cu creșterea Cr scade pentru reacțiile exoterme și crește endotermice la.
Efectul p pentru a schimba echilibrul chimic. dacă raportul presiunilor parțiale de neechilibru (conform z.d.m.) mai puțin Cr. echilibrul este deplasat spre formarea de produse, în cazul în care mai Kr. echilibrul este deplasat spre formarea reactanților.
4. Echilibrul reacției 2H2 (g) + O2 (g) 2H2O (g); # 916; H <0 смещается вправо при:
1) creșterea temperaturii; 2) presiunea este redusă; 3) creșterea presiunii?
Toate substanțele din sistem - gaze. În conformitate cu principiul Le Chatelier. creșterea presiunii conduce la o deplasare a echilibrului la reacție laterală rezultând mai puține moli de gaz, adică, spre formarea H2 O. Prin urmare, creșterea presiunii în sistemul comută reacția de echilibru la dreapta. Răspuns: Când presiunea crește.
5. În ce direcție se va deplasa echilibrul de reacție 2SO2 (g) + O2 (g) 2SO3 (g); # 916; H <0 при повышении температуры?
ca # 916; H <0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
Problema 1. In sistemul A + C, # 916; H 0 <0, где А, В и С - газы, установилось равновесие. Какое влияние на равновесную концентрацию вещества С окажут: а) увеличение давления; б) увеличение концентрации вещества А; в) повышение температуры?
a) Când curgerea reacției cantitatea totală de substanțe gazoase se reduce de la 2 la 1. În conformitate cu principiul creșterii Le Chatelier presiunii se va deplasa echilibrul spre cantitatea mai mică de substanțe gazoase (adică, spre formarea substanței C), prin urmare, [C] crește.
b) Creșterea concentrației de substanță A se va deplasa echilibrul spre formarea produsului C, adică [C] crește.
c) Deoarece # 916; H 0 <0, теплота выделяется, реакция - экзотермическая. Обратная реакция обязательно будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону веществ А и В и [С] уменьшится.
Variante 1-13. Cum se schimbă viteza liniei și reacția inversă, dacă volumul amestecului de gaze pentru a crește (descrește) n ori?
Zoom de 4 ori
1. De câte ori se va schimba rata de forward reacția N2 (g) + 3H2 (g) 2NH3 (g), în cazul în care presiunea sistemului este crescut de 2 ori?
Creșterea presiunii în sistem este echivalentă cu scădere de 2 ori a volumului de sistem de 2 ori. Astfel, concentrația reactanților va crește de 2 ori. Conform legii acțiunii în masă. viteza inițială a reacției este egală cu VH = k · [N2] · [H2] 3. Atunci când creșterea presiunii este de 2 ori concentrația de azot și hidrogen va crește de 2 ori, iar viteza de reacție devine egal cu vk = k · 2 [N2] · 02 martie [H2 ] 3 = k · 32 [N2] · [H2] 3. relație VCH. / VH arată modul în care rata de schimbare a reacției după schimbarea de presiune. În consecință, VR / VH = k · 32 [N2] · [H2] 3 / (k · [N2] · [H2] 3) = 32. A: Viteza de reacție va crește de 32 de ori.
Calculați: constanta de echilibru a reacției reversibile, inițială și concentrația de echilibru a componentelor în sistemele (cantitățile care urmează să fie calculate sunt marcate în tabel cu x).