Rezumat obtinerea de hidroxid de sodiu - abstrage bancare, eseuri, rapoarte, proiecte și disertații
Hidroxid de sodiu sau soda caustică (NaOH), clor, acid clorhidric, HK1 și hidrogenul este produs în industrie este în prezent metoda de electroliza soluției de clorură de sodiu.
hidroxid de sodiu sau hidroxid de sodiu - un alcalin puternic, numit în viața de zi cu zi caustic utilizate pentru fabricarea săpunului, producția de alumină - precursorul pentru a produce aluminiu metalic, în lakokra-suculentă, industria petrochimică, în producția de mătase artificială, în industria de sinteze organice, precum și alte ramuri ale economie.
Atunci când se lucrează cu clor, acid clorhidric, acid clorhidric și hidroxid de sodiu necesar să se respecte cu strictețe regulile artei, fără pericol. clor inhalare provoacă o tuse bruscă și dispnee, membranele mucoase Soare-palenie ale căilor respiratorii, edem pulmonar, și formarea în continuare a inflamatorii in focarele plamani.
Clorura de hidrogen, chiar și cu puțin conținut în aer provoacă iritații la nivelul nasului și gâtului, furnicături în piept, răgușeală și astm. În intoxicații cronice, în concentrații mici, aceasta a afectat în special smalțul dinților, care este distrus rapid.
otrăvirii Acidul clorhidric este foarte similar cu otrăvirea cu clor.
Metode chimice pentru producerea de hidroxid de sodiu.
Procedeele chimice includ producerea de hidroxid de sodiu din vestkovy și ferită.
Metoda de obținere a varului de hidroxid de sodiu cuprinde reacția unei soluții de sodă, cu lapte de var într-un ritm-turii de aproximativ 80 ° C Acest proces este numit causticizing; este descrisă prin reacția
Na2C03 + Ca (OH) 2 = 2NaOH + CaC03 (1)
În Reacția (1) se obține prin soluție de hidroxid de sodiu și carbonat de calciu precipitat. Carbonatul de calciu se separă de soluție, co-tory evaporat pentru a da un produs topit conține% NaOH aproximativ 92-zhaschego. Molten NaOH este turnat în butoaie de același Leznov unde se solidifică.
Metoda feritic descrisă prin două reacții:
+ = Fe203 Na2C03 Na20 • Fe203 + C02 (2)
Na20 • Fe203 -F H20 = 2 NaOH + Fe2O3 (3)
Reacție (2) prezintă procesul de sinterizare a carbonatului de sodiu cu oxid de fier, la o temperatură de 1100-1200 ° C Astfel, pe spec razuetsya - ferita de sodiu și dioxid de carbon este eliberat. Spectru suplimentar tratat cu apă (levigat) conform reacției (3); soluția obținută de hidroxid de sodiu și precipitatul Fe2O3, care, după separarea de soluția este reintrodusă în procesul tehnologic. Soluția conține aproximativ 400 g / l NaOH. Sa evaporat pentru a da pro-produs care conține aproximativ 92% NaOH.
Metodele chimice sunt producția de hidroxid de sodiu LARG dezavantaje esențiale: o cantitate mare de combustibil consumat, preparate caustică impurități soda vehicule de serviciu laborioase și alte mele contaminate In prezent, aceste metode înlocuite aproape în întregime prin metoda de producție electrochimice ..
Conceptul de electroliză și a proceselor electrochimice.
procesele-elek tenĠialului numite procese chimice pro-Tek în soluții apoase sau se topește sub influența durată de curentul electric.
Soluții sau topituri de soluții de săruri, acide și alcaline, numite electroliți-Du- se referă la conductorii de al doilea tip, în care un curent electric este realizată prin transfer de ioni. (Conductoarele de primul tip, cum ar fi metalele, curent este purtat de electroni). Când trecerea curentului electric prin deversarea de electroni-Trol are loc prin electrozi și ioni sponds alocate substanțelor de funingine. Acest proces este numit electroliza. Unitatea în care electroliza se numește electron-trolizerom sau baia de electrolit.
Electroliza este utilizat pentru a produce un număr de clor pro-chimice duktov-, hidrogen, oxigen, alcaline și altele. Dinte, trebuie remarcat faptul că obținute prin electroliză chimice SEASON puritate Coy, în unele cazuri, inaccesibile metodelor chimice pentru producerea lor.
Dezavantajele proceselor electrochimice includ consumul de energie ridicată în timpul electrolizei, ceea ce mărește costul produselor rezultate. În legătură cu acest comportament-ing procese electrochimice este recomandabil numai pe baza ieftine electric TION energie.
Materiile prime pentru producerea de hidroxid de sodiu.
Pentru a produce hidroxid de sodiu, clor, soluție de acid clorhidric este utilizat, care este supus electrolizei Clorură de sodiu se găsește în natură sub formă de depozite subterane de rocă de sare în apele lacurilor și mărilor și naturale Russo-pescuit sau soluții. depozite de sare Rock sunt Donbas in Ural, Siberia, Zak-Cazier și în alte zone. Bogat în sare în țara noastră și o parte din lac.
În timpul verii este vaporizarea apei de suprafață a lacurilor și POWA rennaya sare precipită ca cristalul de pescuit. O astfel de sare numitul clorhidric samosadoch. Seawater conține până la 35 g / l clorură de sodiu. In zonele cu climat cald, în cazul în care în intensitate de evaporare a apei formate soluții concentrate de clorură de sodiu, din care zuetsya cristal. Interiorul Pământului, curgerea apei freatice în formațiunile de sare care se dizolvă NaCl și formează saramurile subterane, extinzându-se prin puțul de foraj la suprafață.
soluții saline, indiferent de calea de preparare a acestora conține săruri impurități de calciu și magneziu și înainte ca acestea sunt transferate la unitatea de electroliză, podver gayutsya-purificată din aceste săruri. este necesară Curățarea, deoarece în timpul electrolizei se poate forma hidroxizi slab solubile de calciu și magneziu, care încalcă cursul normal al electrolizei.
Curățarea saramuri produse de soluție de sodă și laptele de var. În plus față de soluțiile de curățare chimică bozhdayutsya-stapanita de impurități mecanice prin decantare și filtrare.
Electroliza soluției de clorură de sodiu este produs în băi cu fier solid (oțel) și catod cu diafragmele și în băi cu catod de mercur lichid. În orice caz, industriale de electroni-rolizery utilizate echipamente pentru instalațiile mari de clorosodice de astăzi ar trebui să aibă de înaltă performanță, structura pro-stuyu să fie compact, funcționează fiabil și bont-Chivo.
Electroliza soluțiilor de clorură de sodiu în băi cu catod din oțel și anod din grafit.
Aceasta permite producerea de hidroxid de sodiu, clor și hidrogen într-un singur aparat (celule electrolitice). La trecerea unui curent electric continuu printr-o soluție apoasă de clorură de sodiu, se poate aștepta evoluția clorului:
2CI- - 2e Yu C12 (a)
și oxigen:
20N- - A 2-Yu 1 / 2O2 + H2O (b)
potențial de electrod normal de evacuarea OH - ionilor doresc să creeze un composition- + 0,41 în, iar potențialul de electrod normal al descărcării de ioni de clor este egală cu + 1,36. În soluție neutră, concentrația de clorură de sodiu saturată de circa 1 ioni de hidroxil # 903 10-7 g-eq / l. La 25 ° C, potențialul de echilibru al ionilor grei cu descărcare hydroxyechinenone va
Equilibrium potențial de descărcare de ioni de clor la concentrații de NaCl-TION în soluție de 4,6 g-eq / l este egală cu
Prin urmare, la anod, cu suprapotențial scăzut ar trebui să fie în primul rând evacuate oxigen.
Cu toate acestea, grafit Anode supratensiune oxigen supratensiunilor clor mult mai mare și, prin urmare, acestea vor fi în principal C1 descărcarea ionilor cu eliberare de clor gazos prin reacția (a).
clor Izolarea este facilitată prin creșterea concentrației în soluție de clorură de sodiu datorită reducerii în această cantitate capacitate egală de primăvară. Acesta este un motiv pentru utilizarea în electroliza unei soluții de clorură de sodiu concentrată, conținând 310-315 g / l.
La catod într-o soluție alcalină deversarea moleculelor de apă prin ecuația
H20 + e = H + OH- (c)
după recombinarea atomilor de hidrogen se precipită ca un mol de hidrogen molecular,
Refulare ionii de sodiu din soluții apoase pe un catod solid nu este posibilă datorită capacității mai mari de descărcare, în comparație cu hidrogen. De aceea, în soluție de hidroxid rămasă - ioni cu ioni de sodiu pentru a forma soluția alcalină.
Procesul de descompunere poate fi exprimat astfel,-suflare NaCl reacții urmează:
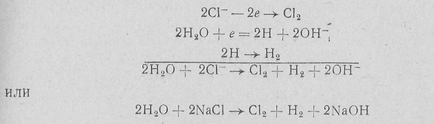
.. Adică, anodul este formarea clorului și la catod - hidroxid de sodiu și hidrogen.
In electroliza, alături de bază procesele descrise pot continua, și lateral, una ecuația descrisă-neniem (b). In plus, clorul dezvoltă la anod este parțial dizolvat în electrolit și este hidrolizat prin reacția
In cazul difuziei (ioni OH-) alcalini la anod sau catod și anod produs hipocloros prejudecată și de acid clorhidric sunt neutralizate cu alcalii pentru a forma clorura de hipoclorit de sodiu și:
NOS1 + NaOH = NaOCI + H20
HK1 + NaOH = NaCI + H20
ioni ClO- la anod poate fi ușor oxidat în ClO3-. Prin urmare, din cauza reacțiilor secundare în timpul electrolizei va fi generat hipocloritul, clorură de sodiu și cloratul, ceea ce va conduce la o eficiență și energie de curent utilizare drop-Niju. Mediul de eliberare-fantă mamar mai ușor de oxigen la anod, care se va degrada, de asemenea, performanța de electroliză.
Pentru a reduce apariția reacțiilor adverse, ar trebui să fie cos-da condiții care să împiedice amestecarea anozilor și catozilor pro-ucts. Acestea includ separarea spațiilor anozilor și catozilor diafragmă și filtrare printr-un electrolit opus diafragmă la bord la deplasarea ionilor OH la anod. Astfel de diafragme sunt numite deschideri și filtru din azbest.
Creșterea concentrației și electroliza temperatura NaCl a electrolitului, prin care scade solubilitatea clorului, și de asemenea, reduce concentrația de NaOH în catolit probabilitatea de contracție-schayut reacțiilor secundare.
Creșterea temperaturii electroliza nu crește numai eficiența actuală, dar, de asemenea, conductivitatea electrică a electrolitului, care reduce tensiunea celulei. Astfel, o creștere a temperaturii reduce consumul de energie electrică și, prin urmare, în general, electroliza soluțiilor de clorură de sodiu este realizată la 70-80 ° C
electrolizoare industriale cu diafragma-ing filtru sunt utilizate pe scară largă în industrie. Conducerea o astfel de baie este prezentată în Fig. Baie 1 are un oțel-ment perforat (cu orificiu) catod și anod din grafit. Prin catod strans diafragma filtru placa de azbest.
Soluția de clorură de sodiu, se alimentează în compartimentul anodic, este filtrat prin diafragmă și ajunge la catod. Rata de filtrare electrolit ha acterized așa-numita Fluiditate deschidere v (cm3 / h), în funcție de deschidere Aria secțiunii transversale F (cm-1), h electrolit presiune cap hidrostatică. dia-phragma grosime b (cm) din electrolit și vâscozitatea μ.
La trecerea unui curent electric de clor directă produsă la anod, catod - hidrogen și alcaliilor care, trecând prin catod de-Verstov curge în spațiul catodic și scos din baie.
Circuit de baie cu o diafragmă de filtrare:
1- diafragmă; 2 - catod din oțel;
3 - catod spațial-TION;
4 - un anod; 5 - spațiu anod
În băile nu există o descompunere completă a sării și
set concentrație constantă de alcaline nedescompus și sare.
În efluenții lichidul electrolitic din baia conține 110-120 g / l NaOH și 180-170 g / l NaCl.
Cele Electrolizoare industriale vor avea un mare Produ-clusive se realizează prin creșterea sarcinii. Utilizarea catozi, cu o suprafață foarte mare vă permite să creați pe cineva Electrolizoare cu o sarcină compact de până la 50.000 a. Diafragma în acest caz nasasyvayut sau „depozitate“ pe suprafața catodului din pasta de fibre de azbest în soluție salină alcalină, cu ajutorul vacuumului.
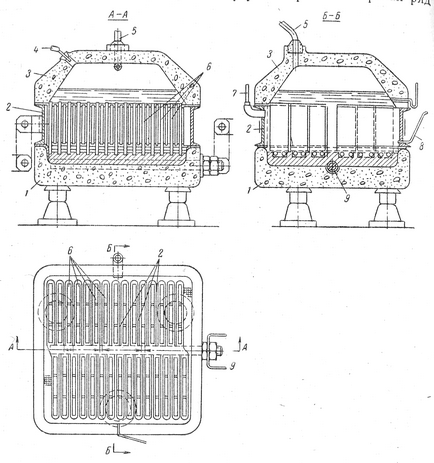
Fig. 2. Baie cu o diafragmă depuse:
1- fund din beton; 2 - catod din oțel; 3 - capac din beton; 4 - o conductă pentru alimentarea saramurii; 5 - o conductă pentru descărcarea de clor; 6 - anozi de grafit; 7 - montarea pentru îndepărtarea hidrogenului; 8 - un tub pentru a se scurge lichidul electrolitic; 9 - Cupru Curenți admisibili
Un exemplu de o baie cu diafragma depozitată poate servi tip baie Hooker S, Fig. 2. Această baie este format din trei stey principale cha - beton de jos, cu catod de oțel și acoperirea cu beton. Partea de jos a jgheabului are o formă dreptunghiulară, în care-umplut porc Tzom capetele inferioare ale barei anozi de grafit și cupru servind pentru alimentarea cu curent. anozi din grafit sunt pla-Stina. Catodul - cadru din oțel, în care este montat un număr de plasă de oțel plat buzunare. buzunare localizare și lățimea lor este astfel încât instalarea catodului la partea de jos, astfel încât buzunarele sunt plasate exact între anozii.
Capacul de baie sunt deschideri pentru alimentarea cu saramură și descărcarea de clor. Celula are o izolație termică reduce pierderile de energie din cauza căldurii a emisiilor în mediu.
soluții Electroliza băi de clorură de nuci dence cu catod de mercur și un anod de grafit vym.
Acesta oferă mai multe produse concentrate, baie decât în băi cu o diafragmă.
La trecerea printr-o soluție de NaCl DC-sky Curentul electric la anod din grafit are loc cu evacuarea ion C1 în următoarea versiune de clor gazos
La catod de mercur, evoluția hidrogenului are loc cu o supratensiune mare. Dacă catod de fier cu eliberare potențială de hidrogen dintr-o soluție neutră este egal cu 0,415, apoi pe un catod de mercur este 1.7-1.85 in. Sodiu același mercur eliberat cu mare efect de depolarizare cauzate de sodiu NaHgn formează un amalgam, dizolvarea mercurului în exces. Bla Godard acest potențial de descărcare de sodiu la catod de mercur-INDICA se dovedește mai jos echilibru, și anume 1,2, în timp ce potențialul său încă de primăvară este egal cu 2,71. Astfel, următoarele procese au loc la un catod de mercur:
hidrogen și, practic, aproape nu alocate.
amalgam de sodiu se descompune într-un aparat special - descompunător prin reacția cu apă
NaHgn + H20 = NaOH + 1 / 2H2 + NHG
baie cu catod de mercur Electroliza curge în medie, la o tensiune de 4,3-4,4 in.
Baie cu catod de mercur, o diagramă schematică este prezentată în Fig. 3, este format din două părți: electrice Leeser și descompunător.
Pila de celulă și poate fi în mod constructiv Sec-Lena și să comunice între ele sau conductă pot fi dispuse într-o carcasă comună.
În orice caz, electrolizorul - o secțiune lungă dreptunghiulară-box cruce, partea superioară acoperită cu un capac, în care anozii de grafit armat. Fig. 3. Baie Schema cu catod de mercur:
1- electrolizor; 2 - descompunător; 3 - Pompă
Prin ușor înclinată de jos cada este adus ka-todnaya anvelope pe aceasta și care se deplasează în mod continuu strat subțire de mercur. Astfel, partea de jos a băii este catod. Celula este alimentată cu un (310-315 g / l), soluție de clorură de sodiu concentrată, care este sărăcit în timpul electrolizei de sare obișnuită la o concentrație de 260-270 g / l este evacuat din obeskhlorivaetsya baie sub refulare și sub purjare de aer comprimat, donasyschaetsya sare, purificată din impurități (de circuit nu sunt prezentate) și transmise înapoi la electroliză. Ieșirea clor rezultat prin capacul de baie.
Când se deplasează mercurul în partea de jos a amalgamului de sodiu cu celule electro-leasing este obținut, care se dizolvă în mercur și în afara celulei din dezamalgamare. Dezmembrare pot fi de diferite construcții - orizontale și verticale. perturbatorii orizontale sunt jgheab dreptunghiular resigilat. Apa intră descompunător și din produsele rezultate retrase - hidrogen și alcaline. fund