Cum de a găsi numărul de protoni și neutroni
Fiecare atom corespunde elementului de substanță din tabelul periodic. Găsiți un element al unui atom, numărul de protoni și neutroni din nucleu să fie găsit. Se determină greutatea atomică a elementului. Acesta este situat în partea de jos a celulei, în cazul în care elementul chimic. În cazul în care numărul de masă este reprezentat de o valoare fracționată, se rotunji la cel mai apropiat întreg. Acest număr este egal cu numărul de nucleoni din atom. De exemplu, se determină greutatea atomică a magneziului. Găsiți acest element în tabelul periodic, acesta are o denumire Mg. Numărul său de masă este de 24.305. Runda l la întreg și obține 24. Aceasta înseamnă că numărul de protoni și neutroni (nucleoni) în nucleul unui atom al elementului este de 24.
Se determină numărul de protoni din nucleul atomului. Pentru a face acest lucru, găsiți în tabelul periodic al elementelor chimice. În partea de sus a numărului său de serie într-un rând într-un element de celulă de tabel este marcat. Acesta este numărul de protoni din nucleul unui atom al unui element. De exemplu, numărul de ordine de magneziu (Mg) este egal cu 12. Aceasta înseamnă că cele 12 protoni conținute în nucleul său.
Uneori, singura cunoscută taxa nucleară în pandantiv, apoi, pentru a găsi numărul de protoni. Se împarte acest număr de sarcina unui proton, care este egal cu 1,6022 • 10 ^ -19 Coulomb. De exemplu, în cazul în care se știe că taxa nucleară de 35,2 • 10 ^ -19 Coulomb, apoi împărțirea la 1,6022 • 10 ^ -19 obține numărul. aproximativ egal cu 22. Aceasta înseamnă că există 2 protoni în nucleul atomului.
După determinarea numărului de protoni obține numărul de neutroni din nucleu. Pentru a face acest lucru relative nucleele atomice de greutate găsite prin intermediul tabelului periodic al elementelor chimice, se scade numărul de protoni. conținute în nucleu. Pentru că, în plus față de neutroni alte particule grele din nucleul unui atom nu este conținut, acesta va fi numărul de neutroni. De exemplu, pentru a găsi numărul de protoni și neutroni din nucleul de fosfor (P), localizați-l în tabelul periodic, se determină numărul de masă și numărul de serie al elementului. Numărul de masă este egal fosfor 30,97376≈31, iar numărul de serie 15. Acest lucru înseamnă că, în nucleul atomilor elementului chimic conținut 15 protoni și neutroni 16 = 31-15.
Un atom al unui element chimic compus dintr-un nucleu și învelișul de electroni. Structura unui nucleu atomic compus din două tipuri de particule - protoni și neutroni. Aproape întreaga masă a atomului este concentrată în nucleu, deoarece protonii și neutronii sunt mult mai grele decât electronii.

- numărul elementului atomic, N-Z diagrama.
Neutronii nu au nici o sarcină electrică, adică taxa lor electrică este zero. Aceasta este principala dificultate în determinarea numărului de neutroni - numărul atomic al elementului sau învelișul său electronic nu oferă un răspuns lipsit de ambiguitate la această întrebare. De exemplu, în atomul nucleu de carbon este cuprins întotdeauna 6 protoni, protoni, dar poate fi 6 și 7. Variații elementelor chimice nuclee cu un număr diferit de neutroni in nucleu se numesc izotopi ai acelui element. Izotopii pot fi naturale sau pot fi produse în mod artificial.
Nucleele atomilor desemnat simbolul alfabetic al unui element chimic din tabelul periodic. La dreapta simbolului în partea de sus și în partea de jos există două numere. Numărul de sus este A - este numărul de masă al atomului. A = Z + N, unde Z - taxa nucleară (numărul de protoni) și N - numărul de neutroni. Numărul de jos - este Z - taxa a nucleului. Această înregistrare oferă informații cu privire la numărul de neutroni din nucleu. Evident, este egală cu N = A-Z.
Diferite izotopi ai unui element chimic O serie de modificări care pot fi văzute în înregistrarea acestui izotop. Anumiți izotopi au numele lor originale. De exemplu, nucleul de hidrogen obișnuit nu are un neutron și un proton. Izotopilor de hidrogen deuteriu este un neutron (A = 2, figura 2 de mai sus, de jos 1) și tritiu a izotopilor - doi neutroni (A = 3, figura 3, de mai sus, sub 1).
Dependența numărului de neutroni din numărul de protoni se reflectă în așa-numita diagrama N-Z a nucleelor atomice. Stabilitatea nucleelor depinde de raportul dintre numărul de neutroni și numărul de protoni. Nuclee nuclid pulmonar cel mai stabil atunci când N / Z = 1, adică cu cantități egale de neutroni și protoni. Odată cu creșterea numărului de schimburi de regiune de stabilitate în masă la valorile N / Z> 1, atingând o valoare de N / Z
1.5 pentru nuclee mai severe.
Atomii constau din particule subatomice - protoni, neutroni și electroni. Protonii sunt particule încărcate pozitiv care se află în centrul atomului în miezul său. Se calculează numărul de protoni poate izotopi de numărul atomic al elementului chimic respectiv.
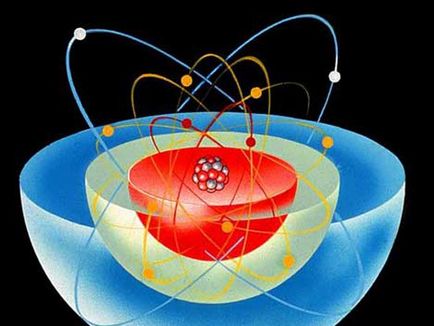
model de atom
Pentru a descrie proprietățile atomului și este utilizat modelul de structură, cunoscută sub numele de „modelul Bohr al atomului“. Conform acestei structuri a atomului seamănă cu sistemul solar - centru de grele (nucleu) este în centru, iar particulele mai ușoare se deplaseze într-o orbită în jurul acestuia. Neutronii și protonii formează nucleul unui pozitiv încărcat, iar electronii încărcați negativ se deplaseze în jurul unui centru, fiind atras de către forțele electrostatice.
Elementul este o substanță constituită dintr-un tip de atomi, este determinată de numărul de protoni în fiecare dintre ele. Elementul este atribuit numele și simbolul, de exemplu, hidrogen (H) sau oxigen (O). Proprietățile chimice ale unui element depinde de numărul de electroni și, în consecință, numărul de protoni conținute în atomi. Caracteristicile chimice nu atom depind de numărul de neutroni, deoarece neutroni nu au nici o sarcină electrică. Cu toate acestea, numărul lor influențează stabilitatea nucleului modificând greutatea totală a atomului.
Izotopi și numărul de protoni
Izotopii atomilor sunt numite elemente individuale cu un număr diferit de neutroni. Acești atomi sunt chimic identice, dar au mase diferite, ele diferă în capacitatea lor de a emite radiații.
numărul atomic (Z) - este numărul ordinal al elementului chimic din tabelul periodic, este determinată de numărul de protoni din nucleu. Fiecare atom are numărul atomic și numărul de masă (A), care este egal cu numărul total de protoni și neutroni din nucleu.
Elementul poate avea un număr diferit de atomi cu neutroni, dar numărul de protoni rămâne aceeași și egal cu numărul de electroni ai unui atom neutru. Pentru a determina cât de mulți protoni conținute în nucleul izotopului, doar uita-te la numărul său atomic. Numărul de protoni egal cu numărul elementului chimic corespunzător din tabelul periodic.
Ca un exemplu, ia în considerare izotopii de hidrogen. În natură, cel mai comun de atomi de hidrogen cu un proton și nu neutroni. În același timp, există izotopi de hidrogen cu nume unul sau doi neutroni, care le-au corespunzătoare. Cu toate acestea, toate au un singur proton, care corespunde numărului ordinal de hidrogen din tabelul periodic. izotopi de hidrogen, cu un număr de masă de neutroni și 2 numit deuteriu sau hidrogen greu, este stabil. Tritiul este un izotop al hidrogenului cu numărul de masă 3 și doi neutroni, radioactive. Este numit uneori hidrogen super-grele și nucleul de tritiu - Triton.
- Radiații Introducere în protecția împotriva radiațiilor